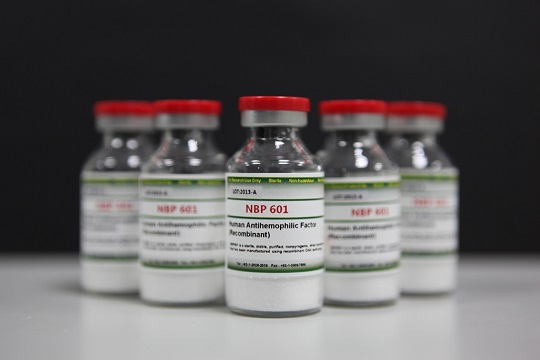
국내에서 개발된 바이오 신약으로는 최초로 미국 FDA 시판 허가 승인을 획득한 NBP601
NBP601은 SK케미칼이 지난 2009년 호주 CSL사(CSL Limited. 이하 CSL)에 기술 수출한 바이오 신약 물질로 국내 제약사가 개발한 바이오 신약이 FDA 시판 허가를 받은 것은 이번이 처음이다.
미국에 이은 세계 주요국 진출도 가시권이다. NBP601은 현재 유럽과 호주에서 허가 당국에 의한 최종 시판 승인 단계에 있는 상태다.
SK케미칼은 바이오 신약의 불모지였던 국내에서 2009년 국내 최초로 바이오 신약의 기술 수출에 성공, 상용화까지 이르게 됐다. SK케미칼 박만훈 사장은 “R&D에 대한 오랜 투자가 결실로 맺어졌다”며 “뛰어난 효능과 환자 편의성이 성공적인 글로벌 상업화의 원동력이 될 것”이라고 말했다.
NBP601은 세계에서 최초로 SK케미칼이 개발한 ‘단일 사슬형 분자구조(single-chain product)를 가진 제8인자3)’ 이다. 기존 혈우병치료제는 분리된 두 개의 단백질이 연합된 형태였다. 그러나 NBP601의 단일 사슬형 분자구조는 두 단백질을 하나로 완전 결합시켜 안정성을 획기적으로 개선, 효능과 약효의 지속 시간을 향상 시켰다.
글로벌 임상 결과 NBP601은 주2회 투여로 예방 효과를 볼 수 있다. 이는 주기적으로 주 3~4회 투여해야 하는 기존 제품 대비 환자의 편의성이 개선된 것이다. 또 A 형 혈우병 치료제의 가장 심각한 부작용인 중화항체반응4)은 단 한 건도 보고되지 않아 안전성을 입증했다.
NBP601의 임상에 참여한 미국 시카고 러시대학 메디컬센터 (Rush University Medical Center)의 리사 보기오(Lisa Boggio) 교수는 “분자 안정성과 효능의 지속성이 명확히 개선됐다”며 “세계 최초 단일 사슬형 치료법의 FDA 시판 허가를 통해 환자와 의료 관계자는 새로운 치료 대안을 얻게 될 것”이라고 말했다.
글로벌리서치업체 데이터모니터에 따르면 미국 내 A형 혈우병 치료제 시장은 2014년 기준 3.6조 원(30억 달러) 규모다. 이는 8.4조원(71억 달러)에 달하는 전 세계 시장 중 가장 크며 2023년엔 약 33% 증가한 4.9조원(41억 달러)으로 성장할 것으로 예상되고 있다.
SK케미칼은 NBP601이 미국 A형 혈우병 치료제 시장의 기존 제품을 빠른 속도로 대체할 것으로 예상하고 있다.
이진수 기자 brownstock@hanmail.net