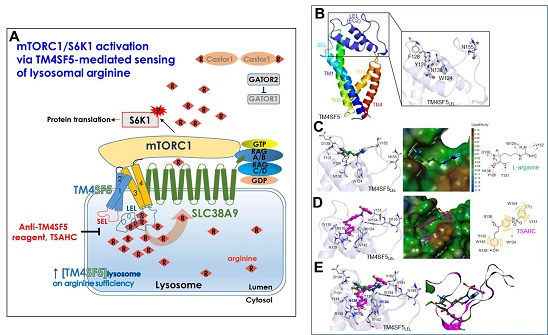
TM4SF5의 아르지닌 감지 및 저해제 TSAHC에 의한 아르지닌 감지 제어 과정
[대전=일요신문] 육심무 기자 = 간암 세포의 증식 및 생존을 위해 절대적으로 필요한 아미노산을 차단해. 간암세포를 굶겨 죽이는 방법이 제시됐다.
한국연구재단은 5일 서울대 이정원 교수와 이와여대 최선 교수 연구진이 간암세포 생존에 필수 아미노산인 아르지닌의 감지 및 이동능력을 차단하는 기술을 개발했다고 발표했다.
임상 연구에서 간암세포는 아미노산 중 하나인 아르지닌을 스스로 생성하지 못하게 되어 외부에서 섭취해야 한다는 것이 확인됐다.
이에 아르지닌 분해효소를 처리해 간암세포가 아르지닌을 이용할 수 없게 하는 치료 시도가 있었지만, 내성이 동반되는 한계를 극복하지 못해 성과를 거두지 못했었다.
연구팀은 아르지닌을 분해하기보다 단백질 합성에 활용되지 않도록 세포질로의 이동을 제한했다.
생리적 농도 수준의 아르지닌을 감지하고 이동시키는 요인이 TM4SF5라는 막단백질임을 동정(同定)하고, 그 저해제를 이용했다.
간암세포가 자식작용을 통해 생체물질을 분해하고 나면 세포소기관인 리소좀 안에 아르지닌이 생긴다.
리소좀 안의 아르지닌 농도가 높을 때 TM4SF5가 이를 감지해 세포막에서 리소좀막으로 이동한다.
그리고 리소좀 안 아르지닌과 결합해 아르지닌 운송자(SLC38A9)에게 전달하여 세포질로 이동하도록 한다.
이때 TM4SF5와 함께 리소좀막으로 이동한 신호전달인자 mTOR와 단백질 합성에 중요한 하위인자 S6K1의 활성화가 일어나고, 세포질로 이동된 아르지닌은 간암세포의 생존과 증식에 활용된다.
연구팀이 그동안 개발해 온 TM4SF5 억제 화합물(TSAHC)을 이용하면 TM4SF5와 아르지닌의 결합을 억제하고, 단백질 합성 신호전달에서 중요한 기여를 하지 못하게 저해할 수 있다.

이정원 교수
이정원 교수는 “그동안 정확하게 밝혀지지 못했던, 리소좀 내부의 아르지닌 감지 센서를 생리적 수준에서 동정했다”면서 “또한 아르지닌의 이동성을 제어함으로써, 궁극적으로 간암세포를 굶겨 죽이는 기전과 단서를 확인했다”고 설명했다.
이 연구 성과는세포 대사 분야의 국제학술지 ‘셀 메타볼리즘(Cell Metabolism)‘에 4월 5일(한국시간) 게재됐다.
ilyo08@ilyo.co.kr